创胜集团 - 全整合型国际化生物制药公司
创胜集团, 生物药, 抗体, 药物研发

活动日历
2023年8月24-25日,APRL 第十二届亚洲医药研发领袖峰会在上海成功举行。创胜集团首席执行官钱雪明博士受邀在“专场三 抗体与偶联药物开发新进展”作了题为《第二代CLDN18.2抗体Osemitamab (TST001)的发现及临床开发》的主题演讲,钱博士从胃癌治疗概况、胃肠道癌症新型治疗靶点CLDN18.2、第一代抗CLDN18.2单抗Zolbetuximab的临床试验结果和局限性、Osemitamab (TST001)的差异化和临床进展,以及其成为同类最佳药物的前景等五个方面进行了详细的阐述。
作为第二代抗CLDN18.2单抗,Osemitamab (TST001)与Zolbetuximab相比,具有更高的靶点亲和力,并在低表达细胞上,展现出了更强的生物活性。Osemitamab (TST001)在胃癌患者中安全性、耐受性良好。由于对CLDN18.2中至低表达的患者也有显著疗效,Osemitamab (TST001)的获益人群更为广泛。在今年举行的ASCO、ESMO GI等国际医学大会上,创胜集团公布了Osemitamab (TST001) 联合CAPOX作为胃或胃食管连接部癌一线治疗的最新临床数据,DOR(持续有效期)和PFS(无进展生存期)等数据较Zolbetuximab有显著提升。联用疗法可能成为未来胃癌治疗的新标准治疗,商业前景广阔。此外,创胜集团还同步开发了一种伴随诊断抗体,可以更精确地检测患者的CLDN18.2表达水平,并筛选出最适合接受Osemitamab (TST001)治疗的患者,从而提高治疗效率和经济性。

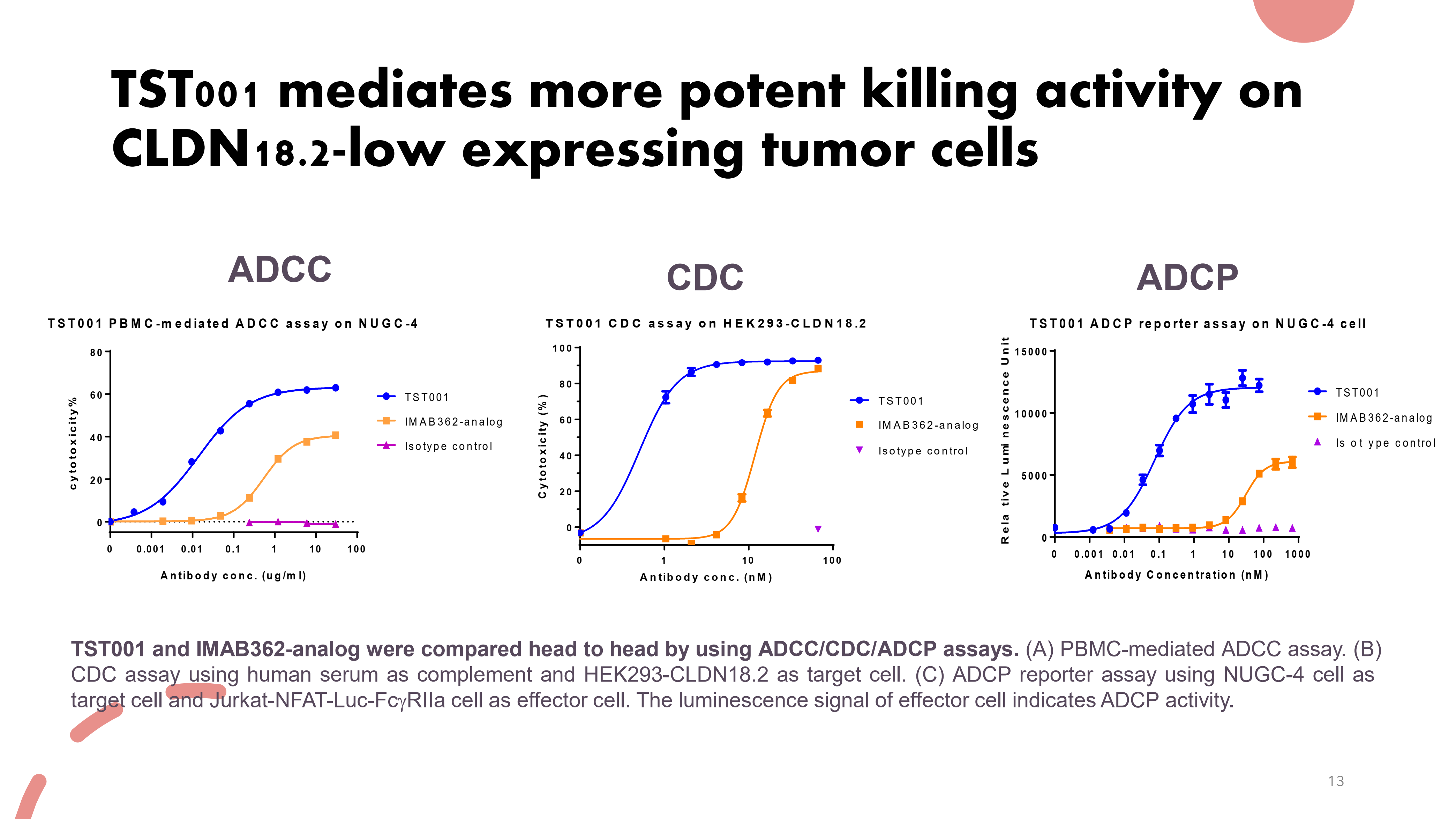
临床数据表明,Osemitamab (TST001)对CLDN18.2低表达的肿瘤细胞具有更强的杀伤活性。
创胜集团开发的伴随诊断抗体,可特异性结合CLDN18.2 而不结合在正常肺组织中高度表达的CLDN18.1,大大助力Osemitamab (TST001)的精准临床开发。符合GMP标准的伴随诊断试剂盒即将用于Osemitamab (TST001) III期关键性临床试验。

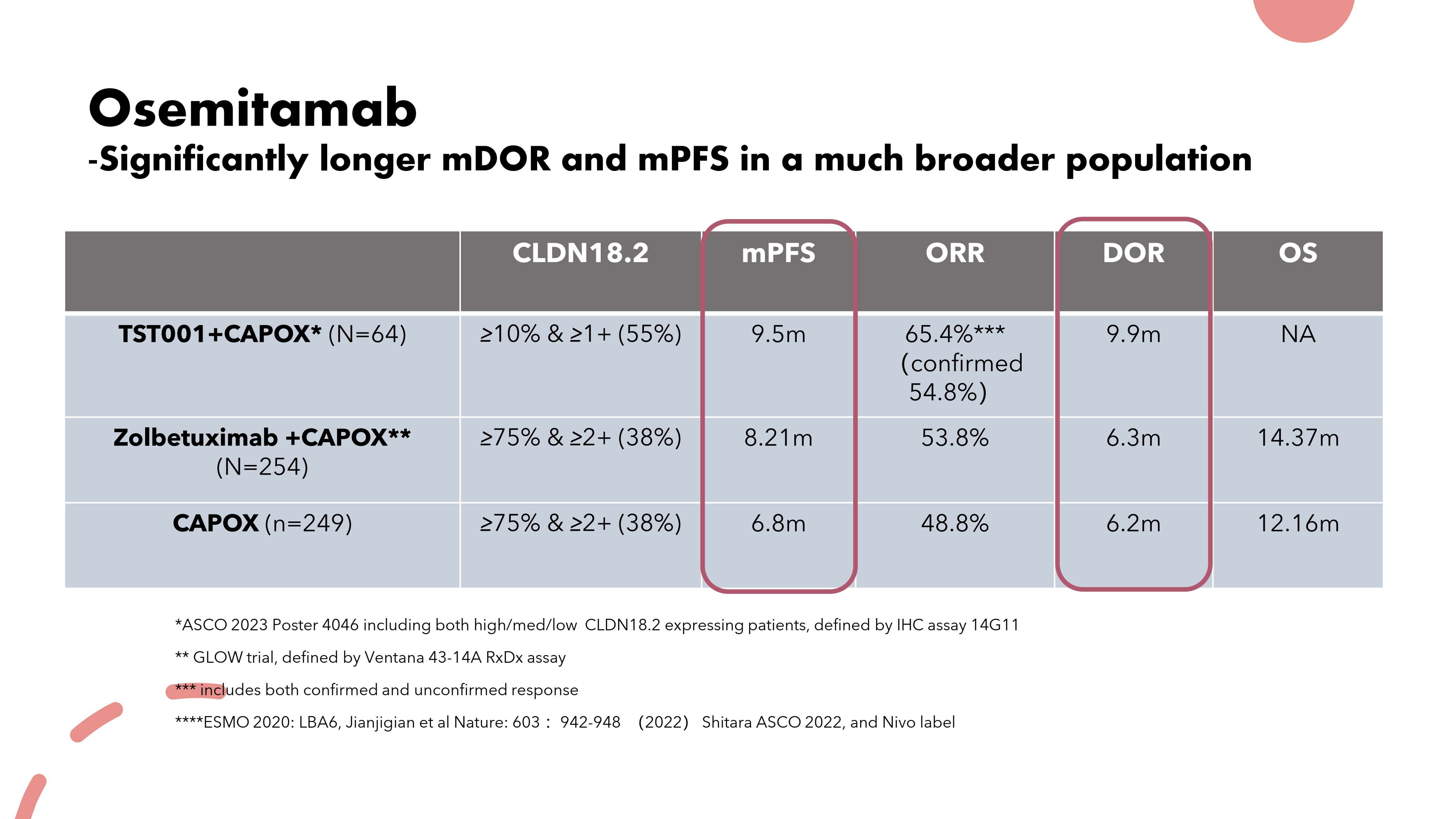
TranStar102 (TST001-1002)研究对CLDN18.2阳性定义为:≥10%的肿瘤细胞有≥1+的膜染色强度,符合条件的患者约占所有胃或胃食管结合部癌患者总数的55%,覆盖了更多CLDN18.2中至低表达的患者。
相较于Zolbetuximab联合CAPOX或CAPOX化药疗法,Osemitamab (TST001)联合CAPOX作为胃或胃食管连接部癌一线治疗展现出了更优异的疗效,所有剂量组的预计中位缓解持续时间为9.9个月,预计中位无进展生存期为9.5个月。
临床前研究已经证明,Osemitamab (TST001)和PD-1单抗在CLDN18.2表达的肿瘤模型中具有协同的抗肿瘤活性。Osemitamab (TST001)与纳武利尤单抗和化疗联用可能成为胃癌患者的变革性治疗选择。
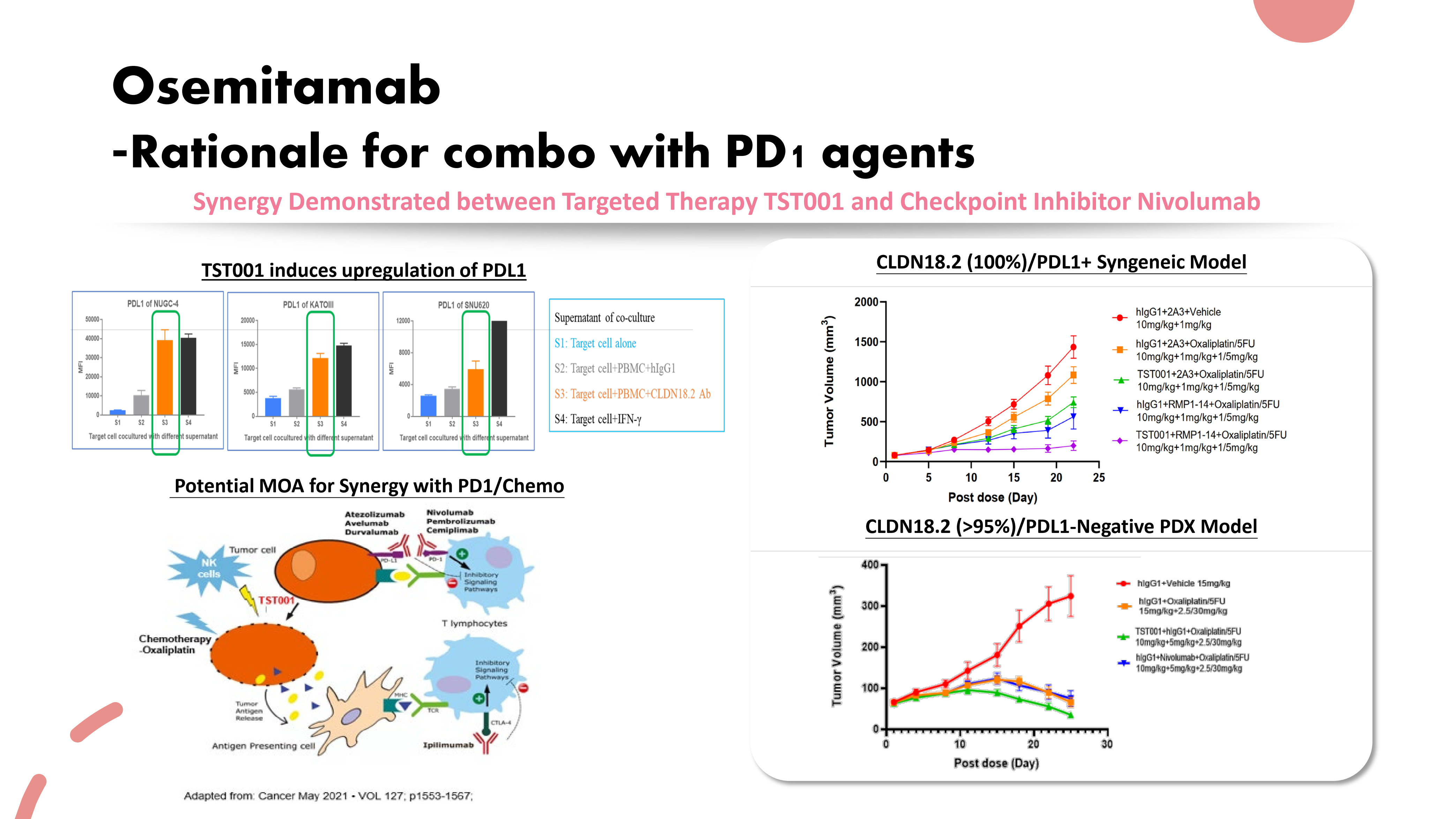
创胜集团正在中美两地开展Osemitamab (TST001)与PD-1抑制剂联用的II期临床试验,希望以此方案开展全球III期临床,保证CLDN18.2阳性的病人获得最佳治疗方案并赢得竞争。

Osemitamab (TST001) TranStar 301全球III期关键性临床试验已获得中国国家药品监督管理局药品审评中心及韩国食品药品安全部批准,与欧盟和FDA的监管互动正在进行中。陆续将在美国、亚洲、欧洲等国家全面开展。
除了胃癌或胃食管连接部癌的适应症外,Osemitamab (TST001)还具有治疗其他Claudin18.2表达肿瘤的潜力,如胃癌围手术期、胰腺癌、肺癌等,为实体瘤患者提供更多治疗希望。
如您想了解更多关于Osemitamab (TST001)的信息,请联系BD@transcenta.com或IR@transcenta.com。

创胜集团将于ESMO ASIA公布Osemitamab三联疗法一线治疗晚期胃或胃食管结合部腺癌的I/II期更新疗效分析

Bioprocess Summit: Intensified and Continuous Bioprocessing-Driving Efficiency, Cost, and Sustainability

创胜集团将于ASCO 2025年会公布Osemitamab联合纳武利尤单抗与CAPOX作为晚期胃癌或胃食管连接部癌一线治疗的I/IIa期G队列更新疗效数据

AACR 2025 | 创胜集团将首次公布靶向FGFR2b的新型抗体偶联药物的临床前数据

创胜集团将于ASCO首次公布Osemitamab联合纳武单抗与CAPOX作为晚期胃或胃食管连接部癌一线治疗的I/IIa期研究数据

创胜集团Osemitamab (TST001)与TST003最新临床进展将亮相AACR 2024